
La Agencia Europea de Medicamentos (EMA) ha publicado su informe anual sobre las principales novedades en materia de aprobación de medicamentos, que indica que en 2020 dio luz verde a 39 tratamientos completamente nuevos y emitió un total de 97 opiniones positivas sobre otros fármacos, frente a los 30 y 66, respectivamente, de 2019. La especialidad que más innovaciones acaparó en Europa fue la oncología, seguida de infecciosas y hematología. De las 39 nuevas moléculas, once son para algún tipo de cáncer.
El informe europeo pone de relieve, además, que fue un buen año para el avance en vacunas. Se aprobaron hasta cuatro nuevas inmunizaciones, dos de ellas destinadas a prevenir la infección por Ébola. Asimismo, la EMA dedica un apartado especial a la lucha contra el coronavirus y realiza un repaso de las vacunas y medicamentos evaluados, haciendo hincapié en su interés por acelerar el desarrollo y aprobación de tratamientos seguros y eficaces, a la vez que subraya el trabajo realizado por mantener sus altos estándares de calidad, seguridad y eficacia.
Al otro lado del Atlántico, la agencia reguladora estadounidense de medicamentos (Food and Drug Administration, FDA) también ha hecho público ya su informe sobre nuevos medicamentos aprobados en 2020, que supera incluso los buenos resultados recogidos en el documento europeo.
La inversión realizada durante años por las compañías farmacéuticas en sus áreas de I+D ha dado como resultado que la FDA aprobara el año pasado 53 nuevos fármacos, la segunda mayor cifra de la última década, sólo superada por las 59 autorizaciones de 2018. De hecho, la FDA ya ha catalogado 2020 como otro año importante para la innovación y los avances terapéuticos.
“El Centro de Evaluación e Investigación de Medicamentos (CDER) de la FDA aprobó el año pasado muchas terapias con medicamentos nuevos para ayudar a una amplia gama de pacientes que padecen patologías muy diferentes, lo que les permitirá mejorar su calidad de vida y, en algunos casos, mejorar las probabilidades de sobrevivir a enfermedades potencialmente mortales”, sostiene la agencia.
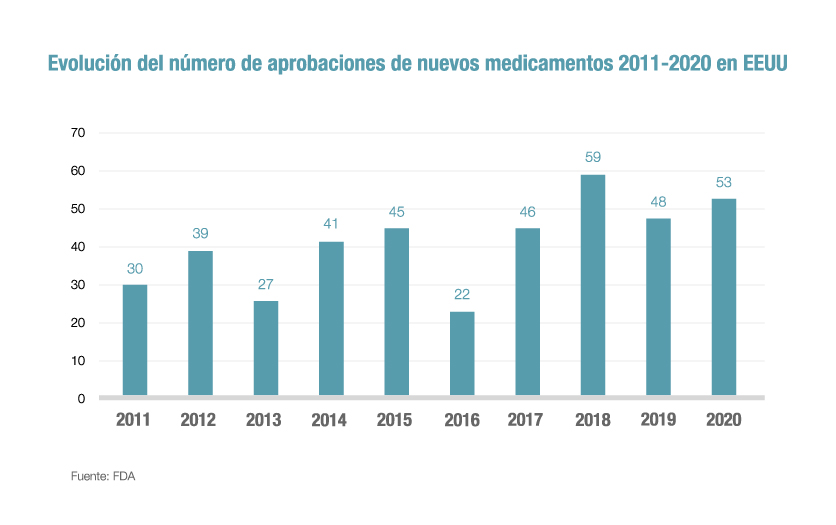
Subraya el informe estadounidense que 21 de las 53 novedades (un 40%) han sido identificadas como first-in-class, es decir, como medicamentos con mecanismos de acción diferentes a las terapias que ya están en el mercado y que tienen un gran potencial de mejora de la salud de los pacientes. Estas innovaciones abren nuevas vías de tratamiento y son una muestra de la calidad de los nuevos fármacos que desarrolla la industria farmacéutica.
Pero si hay un dato que sobresale entre las nuevas aprobaciones de la FDA en 2020 es que el 58% de ellas, esto es, 31 de los 53 medicamentos autorizados para el mercado estadounidense son huérfanos, es decir, que tratan enfermedades raras o poco frecuentes. Una solución oral para tratar la atrofia muscular espinal a partir de los 2 meses de edad, la primera terapia para pacientes pediátricos con enfermedad de Chagas o unas cápsulas para personas con angioedema herediario son algunas de las novedades huérfanas que destaca la FDA en su análisis.
La importancia del acceso rápido a las innovaciones
Por otro lado, dos de cada tres nuevos medicamentos (68%) fueron evaluados con mayor premura de la establecida en la normativa, aplicándoles una tramitación rápida (fast track), una revisión prioritaria o una aprobación acelerada. Como señala el informe de la FDA, hay terapias innovadoras (breakthrough therapies) para enfermedades graves o potencialmente mortales para las cuales se dispone ya de evidencia clínica preliminar que demuestra que el fármaco puede producir una mejora sustancial sobre otras terapias disponibles y que, por tanto, son merecedoras de una evaluación prioritaria porque se considera por la autoridades que estos medicamentos pueden brindar importantes avances a los pacientes antes que con las aprobaciones tradicionales.
“Más importante que la cantidad de nuevas terapias incluidas en este informe es su valor clínico y las nuevas funciones que estos medicamentos están cumpliendo para mejorar la atención de los pacientes”, subraya en el propio documento la directora del CDER, Patricia Cavazzoni.
 | Innovamos para las personas
| Innovamos para las personas



