
Estrechar la cooperación entre Administración y compañías farmacéuticas e impulsar la participación de expertos clínicos y asociaciones de pacientes en el proceso de evaluación y financiación de los medicamentos huérfanos asegurarían un mejor acceso a la innovación para las personas que padecen algún tipo de enfermedad rara en nuestro país. Este nuevo esquema de trabajo contribuiría a construir un procedimiento ágil, predecible y transparente para eliminar la incertidumbre que ahora mismo viven tanto la industria farmacéutica como los pacientes y sus familias. En estos mensajes insistió la directora del Departamento de Acceso de Farmaindustria, Isabel Pineros, en el encuentro Enfermedades raras o poco frecuentes: un nuevo paradigma, organizado este lunes por la Organización Médica Colegial (OMC) y la Fundación Bamberg.
“Hoy sólo se financian en nuestro país cuatro de cada diez medicamentos huérfanos [1] autorizados por la Agencia Europea de Medicamentos (EMA), y cuando llegan lo hacen más tarde que en los países del entorno. Esto supone una pérdida de oportunidad para los pacientes y sus familias”, aseveró Pineros.
Para corregir esta situación en España y garantizar el acceso a los medicamentos que precisan las personas que padecen enfermedades poco frecuentes, propuso -además de las dos medidas citadas- aplicar a estos tratamientos un procedimiento de financiación acelerada; adoptar criterios de evaluación y financiación específicos que miren más allá del coste-efectividad de estos medicamentos y tenga en cuenta el valor social -un criterio establecido en la Ley de Garantías-; avanzar en los acuerdos de pago por resultados y otros acuerdos de tipo financiero, así como apostar por la medición de resultados en salud, incluso antes de la decisión de financiación.
“Aplicar estas propuestas permitiría hacer más predecible el sistema y, por tanto, conocer cuándo el medicamento puede estar disponible para los pacientes. Las compañías farmacéuticas están dispuestas a encontrar soluciones [2], de la mano de la Administración sanitaria”, subrayó la portavoz de Farmaindustria.
Pineros recordó que el hallazgo de nuevos tratamientos para enfermedades raras requiere la puesta en marcha de ensayos clínicos no convencionales, con un bajo número de pacientes y cuyas conclusiones son menos contundentes que para los fármacos destinados a patologías más frecuentes, por la propia idiosincrasia de estas afecciones. “Reconocer las peculiaridades de estos medicamentos, como ocurre en otros países, pasa por aceptar que los enfoques de evaluación convencionales pueden no ser adecuados para evaluar el valor de los tratamientos destinados a estas enfermedades. Aun así, la industria farmacéutica está apostando por ellos”, dijo.
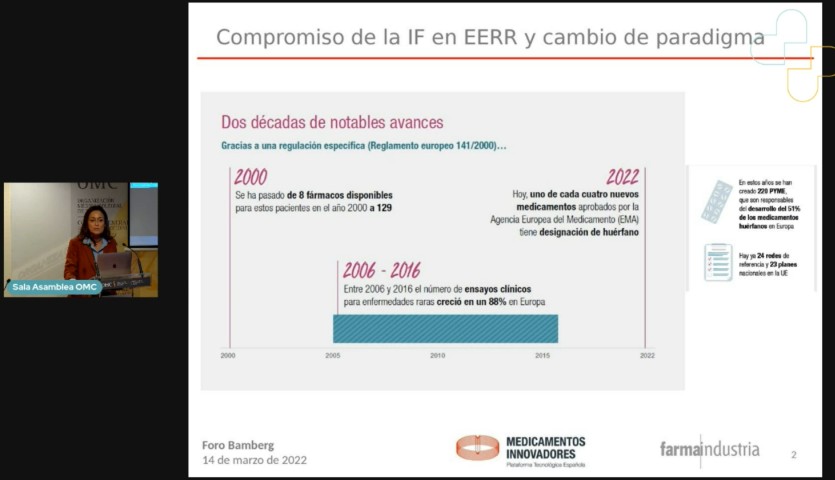
De hecho, en las dos últimas décadas se han producido avances notables para muchas de estas enfermedades, favorecidos por el Reglamento europeo de medicamentos huérfanos (141/2000), como demuestra el hecho de que en el año 2000 eran 8 los fármacos de este tipo disponibles y hoy ya son 129, como recordó en el mismo foro la directora asociada de Investigación Clínica y Traslacional de Farmaindustria, Amelia Martín Uranga.
Amelia Martín Uranga, en su intervención.
España, un país de referencia para la investigación clínica
“España es uno de los mejores países para realizar investigación clínica de medicamentos. Existe un fuerte compromiso por parte de las compañías farmacéuticas en esta área: de los 3.500 ensayos clínicos en marcha, unos 700 (20%) son para enfermedades raras, y un 90% están promovidos por la industria farmacéutica”, informó Martín Uranga.
De estos 700, aproximadamente la mitad son estudios en fase III (la más avanzada) y la otra mitad son en fases I y II, las más complejas, pero, a su vez, una “fuente de esperanza especialmente para las enfermedades poco frecuentes”. Sin embargo, abogó por que los ensayos clínicos se extiendan por todo el territorio nacional, ya que en la actualidad existe una alta concentración en Madrid y Cataluña: “Es fundamental el acceso a los nuevos tratamientos independientemente del código postal de los pacientes”, reclamó.
Finalmente, Martín Uranga destacó que la posición como referente internacional de España en ensayos clínicos es fruto del modelo de éxito que ha demostrado ser la colaboración público-privada, que hasta en los tiempos más complicados de la pandemia supo hallar vías para que los pacientes en ensayos clínicos pudieran seguir recibiendo sus tratamientos y seguir controlados por sus médicos, gracias a la monitorización remota, por ejemplo.