El 74% del aumento de la esperanza de vida de las personas en los países desarrollados se debe directamente a los nuevos medicamentos
El avance de la medicina de precisión exige más recursos en I+D, pero implica mayores esperanzas ante enfermedades muy graves

junio 2025
Las dudas sobre el tiempo necesario para el desarrollo de un medicamento son muy frecuentes, todas las fases que intervienen para crear un nuevo fármaco antes de su venta. El medicamento se ha convertido en el gran instrumento terapéutico de los sistemas sanitarios desarrollados por ser el arma más efectiva para combatir, paliar y curar enfermedades. Su uso está directamente relacionado con el aumento de la esperanza de vida: el 74% de este aumento en los países desarrollados se debe directamente a los nuevos medicamentos. Sin embargo, la investigación de un fármaco y su posterior llegada un día al paciente es un proceso largo, complejo y costoso.
Es largo, porque se precisan entre 10 y 13 años para su desarrollo:
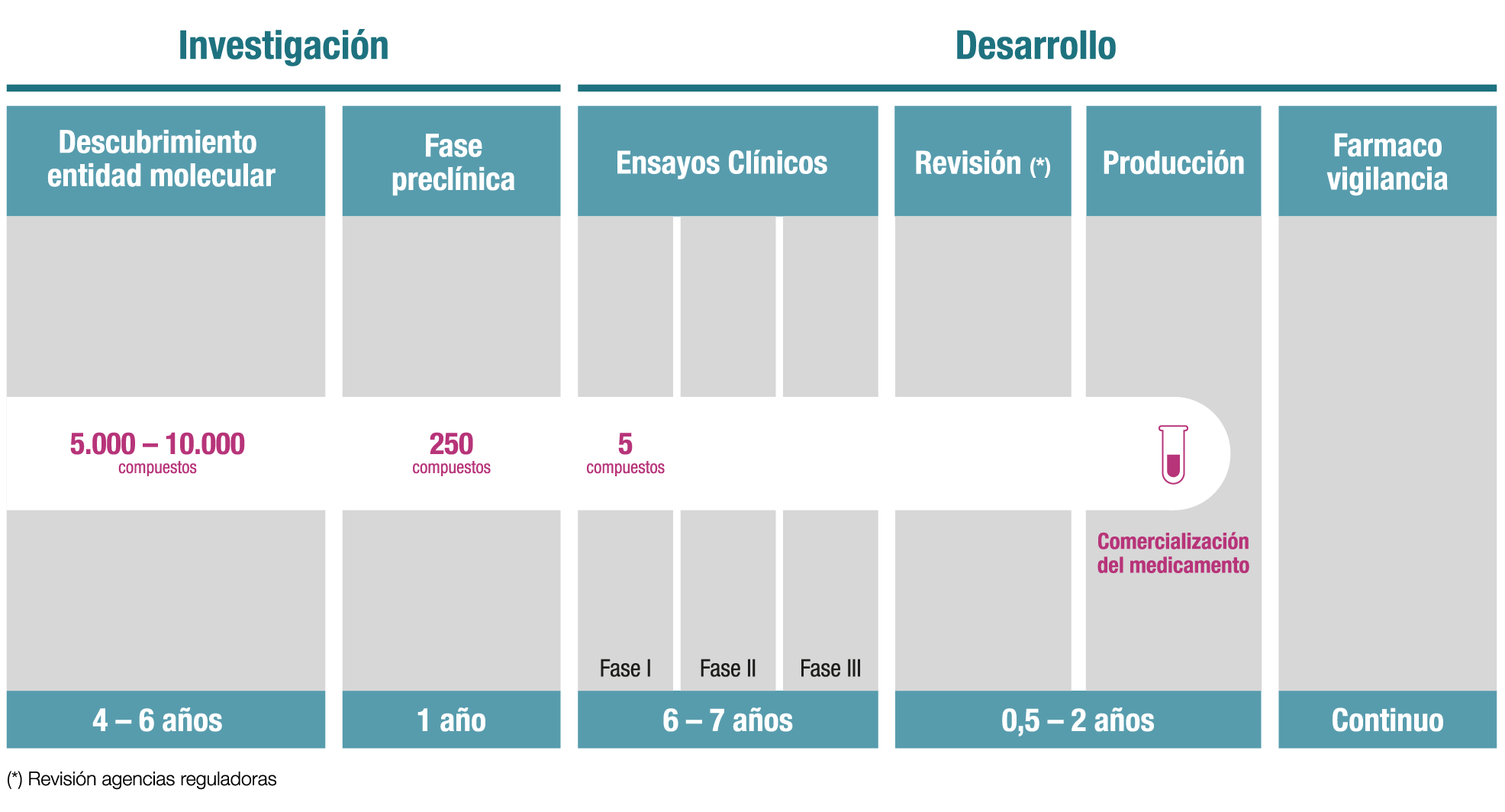
Es complejo, porque requiere la implicación de profesionales con un alto nivel científico y experiencia contrastada y porque sólo 1 de cada 10.000 compuestos llegan finalmente al mercado; y es costoso, porque la inversión de las compañías es muy elevada: unos 2.500 millones de euros por medicamento nuevo que se desarrolla.

Se invierten de media para crear un nuevo medicamento
CREAR UN NUEVO MEDICAMENTO, PASO A PASO
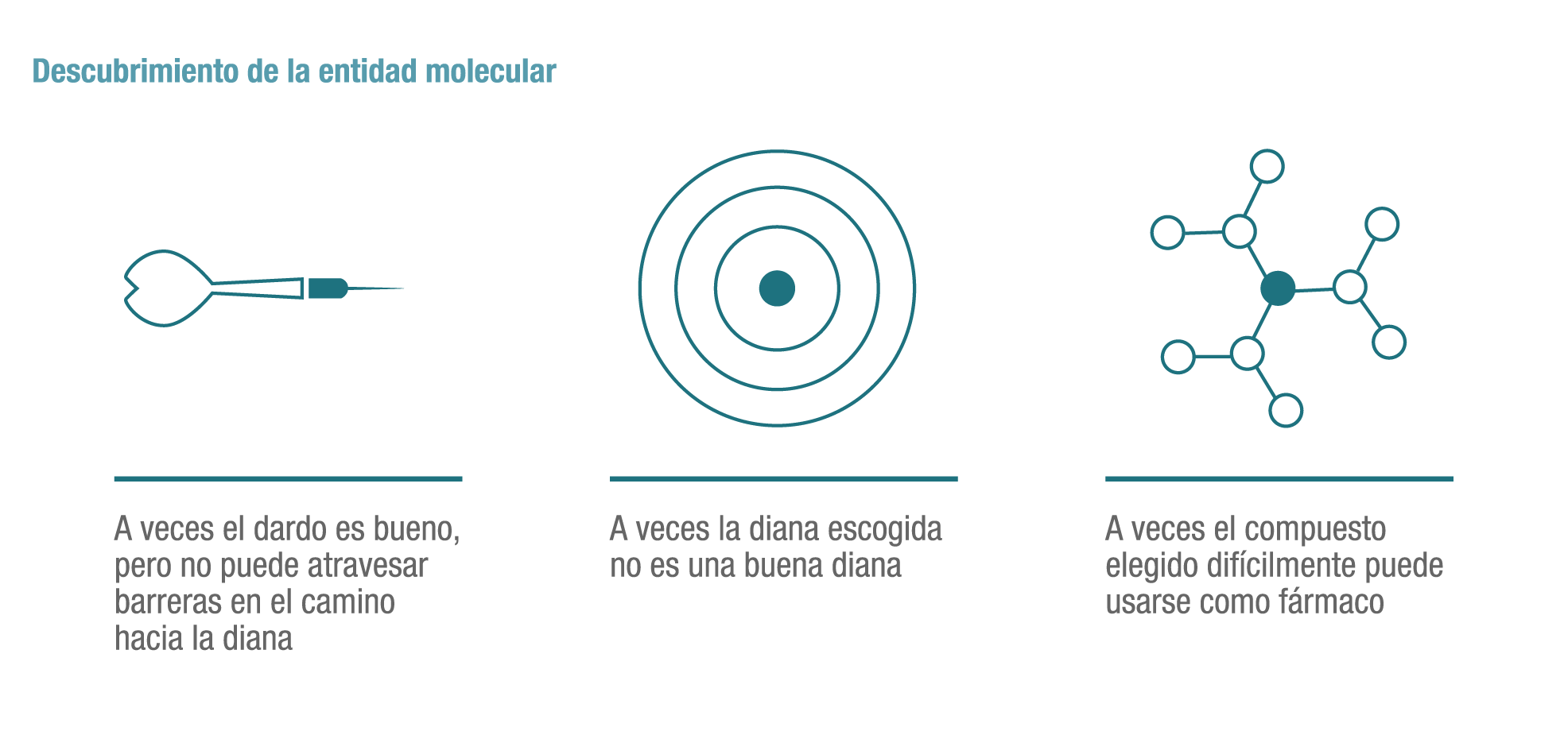
El descubrimiento de un nuevo fármaco comienza en el laboratorio, cuyos investigadores, previamente formados para tener un conocimiento profundo de una enfermedad, identificarán una diana específica (como puede ser el origen de una patología) y ésta será el objetivo al que se dirigirá la nueva molécula o fármaco que posteriormente se desarrollará. Por aquí comienzan los pasos o fases para crear un nuevo. medicamento.
Aquí pueden surgir los primeros obstáculos para el descubrimiento de un nuevo medicamento, porque a veces el ‘dardo’ (la molécula) o la diana no son los adecuados o el compuesto seleccionado finalmente no puede convertirse en un fármaco.
El siguiente paso, que, como el anterior, forma parte del proceso de la investigación, es la fase preclínica, que implica el ensayo del compuesto en organismos vivos y estudios sobre farmacología y toxicología, entre otros. Las compañías farmacéuticas necesitan entre 5 y 7 años para completar estas dos primeras etapas.
Una vez superados estos pasos previos comienza lo que se conoce como fase clínica y es cuando da comienzo el ensayo en el que, por primera vez, participarán personas –normalmente es el médico el que invita a un paciente a participar en el estudio-. Los ensayos clínicos son, en términos generales, estudios de investigación con voluntarios sanos o pacientes que prueban la seguridad y eficacia de un nuevo medicamento.
Son una pieza crítica en la innovación terapéutica y representan una oportunidad única para los
pacientes (puesto que pueden tener acceso a un tratamiento en investigación que puede ser la
última oportunidad para muchos), para los profesionales sanitarios (que participan de la
investigación más puntera) y para la calidad de la prestación sanitaria y del Sistema Nacional de
Salud (puesto que todo ese conocimiento investigador se puede aplicar a la labor asistencial).
Esta fase final de la carrera de fondo que supone la I+D de fármacos consta de cuatro etapas:

El procedimiento administrativo para la aprobación de una nueva terapia también debe tenerse en cuenta al medir el tiempo que tarda un medicamento en estar disponible para los pacientes. De media, a los cinco años que puede durar la fase clínica habría que sumarle entre 12 y 18 meses para que las autoridades regulatorias aprueben su puesta en el mercado.
ESPAÑA, REFERENCIA INTERNACIONAL EN ENSAYOS CLÍNICOS
España es uno de los países representativos en la realización de ensayos clínicos para el desarrollo de nuevos fármacos. El hecho de haber sido el primer Estado miembro en tener una regulación (en vigor desde 2016) adaptada a las nuevas directrices europeas ha contribuido a lograrlo. Para muchas compañías nuestro país es una de las primeras opciones para realizar este tipo de estudios, sólo por detrás de potencias como Estados Unidos.
La preparación de los profesionales sanitarios, la reputación de los centros hospitalarios y la implicación de las asociaciones de pacientes son, junto con el apoyo de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), otras de las palancas que han posicionado bien a España y que ayuda a crear nuevos medicamentos.
Es importante que entre pacientes, familiares, cuidadores e incluso profesionales sanitarios se conozca mejor el valor que tiene la investigación biomédica, en general, y la investigación y desarrollo de nuevos medicamentos, en particular. Por este motivo, Farmaindustria lleva años comprometida con trasladar esta información y conocimiento a la sociedad en su conjunto, porque en la actualidad resulta especialmente relevante y necesaria.

El proyecto Acercando la ciencia a las escuelas, realizado en colaboración con hospitales y centros de investigación españoles y en el que estudiantes de bachillerato conocen en qué consiste el proceso de investigación de un medicamento, es un ejemplo de este compromiso.
Asimismo, la Academia Europea de Pacientes (Eupati) se ha implicado también de manera importante en la divulgación de la importancia de participar en los ensayos clínicos de nuevos medicamentos y en la formación de los propios pacientes para potenciar su participación, por lo que se ha convertido en una fuente de referencia para muchos colectivos de pacientes.
UN FUTURO MARCADO POR LA DIGITALIZACIÓN
¿Y cómo se presenta el futuro de la I+D de medicamentos? Pues, como se ha constatado en los últimos años, la investigación clínica es cada vez más compleja, por lo tanto, los diseños de los ensayos clínicos también se complican, se alargan los tiempos y aumentan los costes para poner un nuevo fármaco a disposición de médicos y pacientes.

El avance de la genómica y la proteómica funcional ha situado a la medicina en los últimos años a las puertas de un nuevo progreso: la medicina de precisión, que se caracteriza por el desarrollo de terapias moleculares, genéticas y celulares que se materializan en tratamientos específicos para pacientes concretos. Esta realidad implica un lógico aumento de los procesos de investigación y desarrollo de fármacos, que dilatan la espera para los pacientes.
Con este gran avance converge una revolución de la digitalización. Los nuevos instrumentos de inteligencia artificial, el manejo de tecnologías predictivas y el uso de datos procedentes del Big Data contribuirán a tomar decisiones más adecuadas durante las fases clínicas del desarrollo del medicamento, lo que aportará eficiencia al propio proceso y más seguridad para los pacientes.