La futura regulación definirá la posición de Europa en innovación de medicamentos y el acceso de los pacientes a ellos
En los 90, Europa estaba a la vanguardia mundial en I+D biomédica, pero hoy sólo desarrolla el 23% de los nuevos fármacos

octubre 2022
La Comisión Europea (CE) tiene previsto lanzar en los próximos meses su revisión de la legislación farmacéutica general, así como de la normativa sobre medicamentos huérfanos y medicamentos pediátricos, en el marco de la futura Estrategia Farmacéutica Europea. El objetivo es garantizar un entorno regulatorio que mejore la disponibilidad y accesibilidad de los medicamentos para todos los ciudadanos, que, a su vez, acreciente la competitividad e innovación de la industria farmacéutica y garantice la sostenibilidad de los sistemas sanitarios.
Este proceso de actualización de la normativa farmacéutica en la Unión Europea (UE) representa una oportunidad única para garantizar que la región pueda beneficiarse de la vanguardia de la I+D, responder rápidamente a las necesidades de los pacientes europeos y volver a ser líderes mundiales en innovación farmacéutica.
Si dicha oportunidad se desaprovecha, Europa corre el riesgo de acelerar la pérdida de investigación biomédica hacia otras regiones -como ha ocurrido en las últimas décadas-, retrasando el acceso de los pacientes a los últimos avances científicos y aumentando la dependencia de países de fuera de la UE para obtener tratamientos y vacunas que salvan vidas.

En este sentido, cualquier propuesta enfocada a limitar los derechos de propiedad intelectual o los incentivos como vía para abordar los problemas de acceso no servirá para detener la pérdida de innovación en Europa en favor de otras regiones del mundo, e incluso la acelerará.
Mientras Europa reevalúa su marco de política farmacéutica, el desafío para las próximas décadas no es si se desarrollará innovación médica, sino dónde ocurrirá. La UE ha sido eclipsada por Estados Unidos como líder mundial en este ámbito y se enfrenta a una competencia cada vez más intensa de China, otros países asiáticos, Suiza o el Reino Unido.
Hallar soluciones colaborativas entre todos los actores implicados en la mejora del acceso a la innovación y crear los marcos de incentivos adecuados para facilitar el descubrimiento y la próxima generación de tratamientos y vacunas en Europa contribuirán a mejorar la salud de los europeos e impulsarán la resiliencia y el crecimiento económico.


La industria farmacéutica europea ha presentado una serie de propuestas concretas para situar de nuevo a Europa a la vanguardia de la investigación biomédica y todo lo que ello implica. El sector entiende que la futura Estrategia Farmacéutica Europea debería conciliar tres objetivos básicos de los sistemas de salud: el mejor acceso de todos los ciudadanos europeos a todos los tratamientos disponibles; la sostenibilidad de las cuentas públicas a través de la colaboración público-privada, implicando a las administraciones, industria farmacéutica, clínicos, comunidad científica y pacientes, y el desarrollo de la actividad innovadora e industrial de las compañías farmacéuticas. En definitiva, conciliar acceso, sostenibilidad e innovación en un marco equilibrado para todos los agentes concernidos.
CÓMO MEJORAR EL ACCESO DE LOS PACIENTES EUROPEOS A LOS NUEVOS MEDICAMENTOS
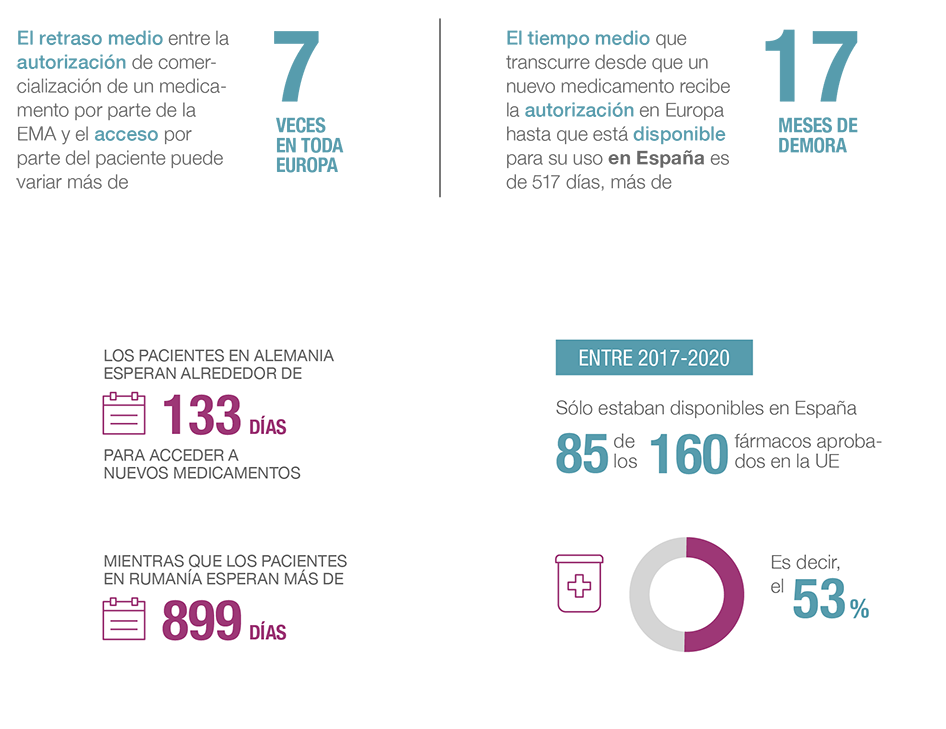
El acceso y la disponibilidad de los nuevos medicamentos para los pacientes es una prioridad para la industria farmacéutica. Hoy, sin embargo, puede variar de 4 meses a 2,5 años, según el país.
El acceso equitativo a la innovación terapéutica en toda Europa es un objetivo alcanzable. Requiere un entendimiento compartido sobre cuáles son los obstáculos y los motivos principales para estos retrasos y, por supuesto, un compromiso de la industria farmacéutica, autoridades comunitarias y Estados miembro para revertir la situación.
Las compañías farmacéuticas ya están haciendo su trabajo y dando muestras de su compromiso con los pacientes. Una de las propuestas concretas es explorar nuevos modelos de financiación para que los precios de los medicamentos reflejen mejor tanto el valor que aportan a los pacientes y a la sociedad como a las economías de los Estados miembro.
Además, las compañías farmacéuticas se han comprometido a solicitar la fijación de precio y reembolso de sus nuevos medicamentos en todos los países de la UE lo antes posible y, a más tardar, dos años después de la autorización de comercialización, siempre que los sistemas locales lo permitan.
Otra medida es la creación de un portal de transparencia donde las compañías farmacéuticas titulares de autorizaciones de comercialización proporcionarán información oportuna sobre los plazos y la tramitación de las solicitudes de precios y reembolsos en los países de la UE-27. Aportar mayor transparencia a los obstáculos y retrasos en el acceso facilitará la búsqueda de soluciones en colaboración con las administraciones.
En paralelo, las compañías farmacéuticas están comprometidas con la disponibilidad y la reducción de los desabastecimientos en la UE. La capacidad de esta industria para proporcionar medicamentos de forma segura a pacientes de toda Europa se puso de manifiesto en las primeras etapas de la crisis de la Covid-19. De la noche a la mañana, se cerraron fronteras, hubo restricciones a la exportación y desapareció el transporte aéreo.
A pesar de un aumento exponencial de la demanda de algunos medicamentos, el sector pudo aumentar la capacidad para satisfacer la demanda, en algunos casos hasta en un 400%, y se gestionaron los problemas de suministro hasta el punto de que ningún miembro de Efpia interrumpió el suministro de productos terminados durante ese periodo extremadamente desafiante.

En este sentido, las compañías farmacéuticas asentadas en Europa proponen un sistema armonizado que palíe y prevenga posibles desabastecimientos en la UE, basado en una definición común de qué es la escasez de medicamentos, mayor claridad sobre cuándo se debe notificar el riesgo a las autoridades, requisitos flexibles en el etiquetado nacional, prospectos electrónicos y la elaboración de un listado con los productos críticos, valorando la probabilidad de escasez, gravedad de la enfermedad a la que va dirigida el tratamiento, interés terapéutico y disponibilidad de alternativas en el mercado.
CÓMO GARANTIZAR LA SOSTENIBILIDAD DE LOS SISTEMAS SANITARIOS
A pesar de los grandes avances científicos de los últimos años, que han puesto a disposición de los pacientes una nueva generación de tratamientos esperanzadores para enfermedades como el cáncer, la esclerosis múltiple, el sida o la hepatitis C, el coste de los medicamentos para la mayoría de los sistemas sanitarios europeos se ha mantenido estable en torno al 15% del gasto en salud. Asimismo, los fármacos huérfanos y las terapias avanzadas sólo representan el 6% del presupuesto farmacéutico en los Estados miembro.
A esto hay que añadir que los nuevos medicamentos ayudan a disminuir el gasto en otros servicios sanitarios: por ejemplo, al reducir las visitas a Urgencias, evitar hospitalizaciones innecesarias o favorecer la vuelta al trabajo de muchos pacientes y de sus cuidadores y familiares, lo que contribuye a generar sistemas de salud y sociedades más sostenibles y resilientes.
La llegada de nuevos tratamientos, pese a suponer para los sistemas sanitarios una inversión de recursos en primera instancia, tiene un efecto secundario muy positivo para los Estados desde el punto de vista económico y social, ya que ahorran costes de una forma muy importante, tanto en el propio sistema sanitario como en la estructura productiva de un país. Es decir, la innovación farmacéutica genera crecimiento económico.

Es cierto que el éxito de la medicina de precisión ha generado un nuevo escenario para los sistemas sanitarios. Sin embargo, cuando se hace un análisis completo, tanto de los fármacos que están por llegar como de los que ahorrarán recursos públicos debido a las pérdidas de patente, la conclusión es que la innovación farmacéutica no supone un peligro para la sostenibilidad financiera de los sistemas.
Lo que es crucial es una actualización y modificación de los modelos de financiación tradicionales para trascender la visión a corto plazo que impone la política presupuestaria e introducir una perspectiva más amplia que tenga en cuenta el valor clínico, económico y social de la innovación y cómo se traduce en ahorro para el sistema a medio y largo plazo.

CÓMO PROTEGER E IMPULSAR LA INNOVACIÓN BIOMÉDICA EN EUROPA
Europa tiene un sólido marco de propiedad intelectual diseñado y ajustado para tener en cuenta las necesidades de la sociedad y para proteger la innovación. La propiedad intelectual es la base sobre la que se construyen los nuevos tratamientos innovadores, ya que fomenta y protege la innovación impulsando las inversiones en investigación y el desarrollo en áreas con necesidades médicas no cubiertas.
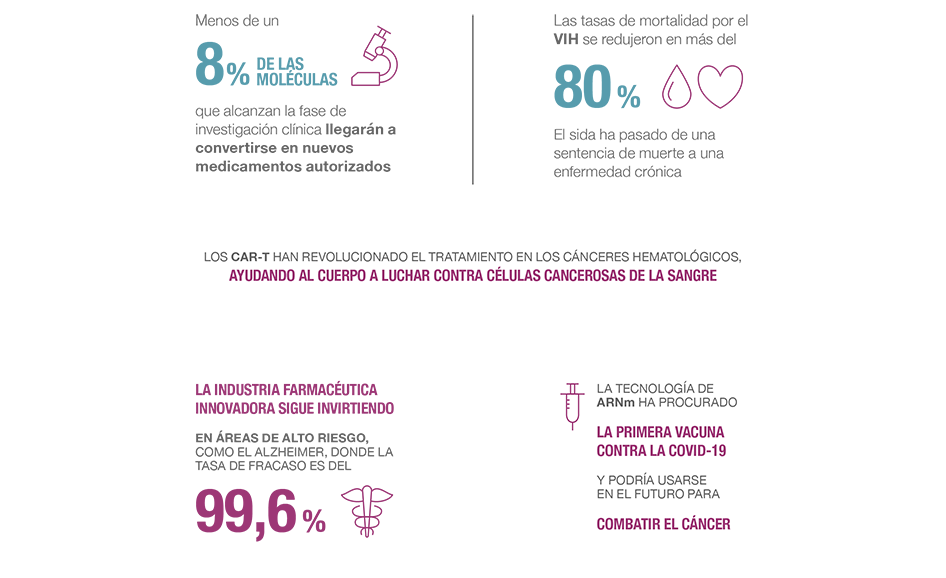
Se tarda, de media, 10 años en desarrollar un nuevo fármaco, con un coste estimado de más de 2.000 millones de euros. El riesgo es enorme y el camino a menudo está plagado de incertidumbre, contratiempos y fracasos. La estabilidad del sistema actual es la que ha permitido a la industria farmacéutica innovadora poner nuevos medicamentos a disposición de los pacientes, de los profesionales y de los sistemas sanitarios, a pesar de que el proceso es largo, complejo, arriesgado y costoso.
Ha trascendido que la Comisión Europea está valorando algunas propuestas que sugieren desestabilizar o debilitar los derechos de propiedad intelectual como una forma de abordar los problemas de acceso a los nuevos medicamentos. Esto pondría en riesgo el ecosistema de investigación biomédica en la UE.
De hecho, los reglamentos europeos sobre medicamentos huérfanos y pediátricos, ahora en revisión por las autoridades comunitarias, son historias de éxito. Las enfermedades raras y pediátricas son algunas de las más complejas. Y el objetivo de la industria farmacéutica es que ningún el paciente se queda atrás.
En las dos últimas décadas se han producido avances notables para muchas de estas enfermedades, favorecidos por el Reglamento europeo de medicamentos huérfanos (141/2000), como demuestra el hecho de que en el año 2000 eran 8 los fármacos de este tipo disponibles y hoy ya son 133.
Aunque el desafío para la investigación sigue siendo enorme en enfermedades raras, el actual marco regulatorio comunitario, basado en incentivos, ha fomentado la inversión privada en la investigación de estos tratamientos y ha supuesto que sólo en la última década los proyectos de I+D en este ámbito hayan crecido un 88%. De hecho, en los últimos años, uno de cada cuatro nuevos fármacos aprobados por la Agencia Europea de Medicamentos (EMA) fue para terapias con designación de huérfano.
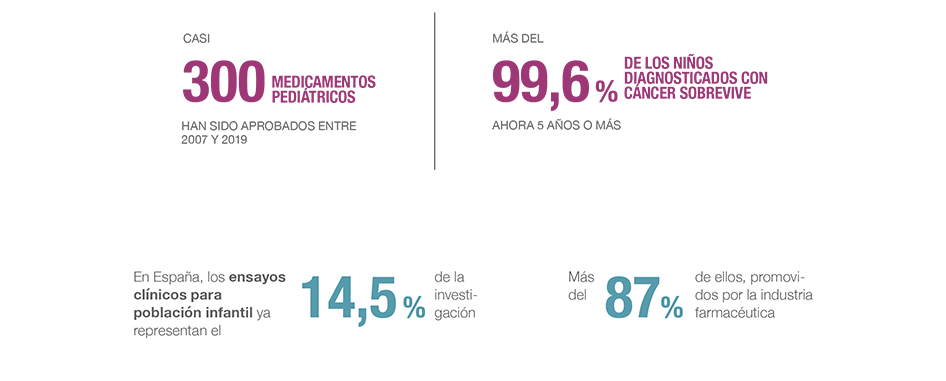
El compromiso de la industria farmacéutica con la investigación pediátrica también se ha visto favorecido en los últimos años por la regulación europea. Esto ha permitido que se hayan aprobado en Europa 296 nuevos medicamentos específicamente indicados para niños entre 2007 y 2019, entre otros, el primer tratamiento para la hepatitis C o terapias para prevenir la transmisión del VIH de madre a hijo. Y, en la actualidad, hay 600 nuevos medicamentos pediátricos en desarrollo.
Los incentivos siguen siendo esenciales para estimular la innovación pediátrica, aunque la industria farmacéutica defiende que se puede hacer más para fomentar la investigación en áreas de enfermedades que afectan exclusivamente a niños. Desde la Efpia, entre otras medidas, se propone un sistema de modulación de la exclusividad de comercialización de un nuevo medicamento donde la duración sea mayor o menor en función del impacto en las necesidades de los pacientes.
Según la legislación pediátrica vigente, las empresas están obligadas a realizar estudios pediátricos sobre todos los medicamentos que desarrollan. Significa que el desarrollo de medicamentos pediátricos tiende a estar dirigido por las necesidades de los pacientes adultos. Es hora de un enfoque más centrado en los niños.
La industria farmacéutica europea propone, además, un enfoque de investigación e inversión colaborativas para abordar los desafíos científicos que frustran la innovación en enfermedades raras y pediátricas y desbloquear áreas históricamente huérfanas de tratamientos.
