
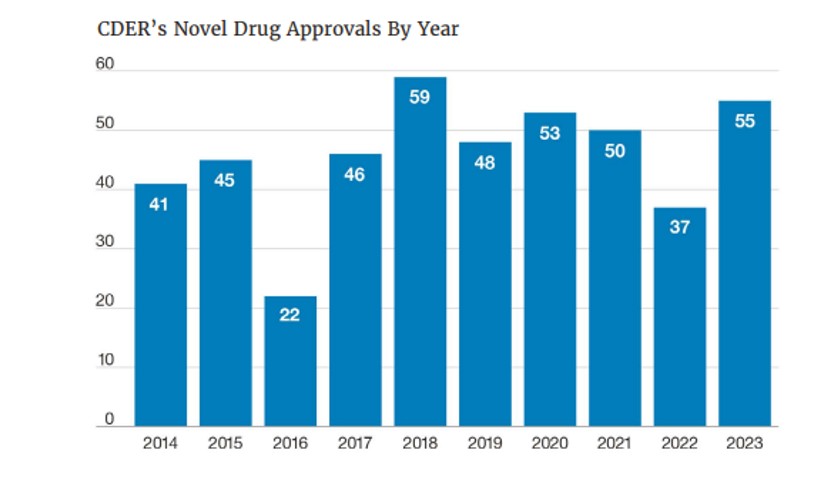
La innovación biomédica y el compromiso de las compañías farmacéuticas con la investigación de nuevos medicamentos y los pacientes sigue avanzando de manera imparable. El Centro de Evaluación e Investigación del Medicamento de la agencia reguladora del medicamento (FDA, por sus siglas en inglés) aprobó 55 fármacos basados en nuevos principios activos en 2023, según el informe anual que recoge los avances del año anterior.
Entre las aprobaciones destacan tratamientos para enfermedades infecciosas, incluidos la Covid-19, el virus respiratorio sincitial (VRS) y el VIH; para afecciones neurológicas, como la esclerosis lateral amiotrófica (ELA), la enfermedad de Alzheimer y la migraña; para la diabetes tipo 2 en niños; distintos tipos de anemia y el control crónico del peso, entre otros fármacos para trastornos cardíacos, sanguíneos, renales y endocrinos. “Estas aprobaciones, que dan cobertura a una amplia gama de enfermedades y estados de salud, tienen como objetivo ayudar a muchas personas a vivir mejor y lograr una mayor esperanza de vida”, explica la FDA en su informe.
Asimismo, más de la mitad de los nuevos fármacos (28 de las 55 aprobaciones) están destinados a prevenir, diagnosticar o tratar una enfermedad rara, por lo que recibieron la designación de medicamento huérfano, lo que ratifica el impulso de la investigación por parte de la industria farmacéutica innovadora en esta área de las enfermedades poco frecuentes, una demanda constante entre profesionales sanitarios y pacientes y sus familiares.
Además de la ELA, han llegado algunas aprobaciones para la ataxia de Friedreich, una enfermedad degenerativa hereditaria que daña el sistema nervioso; para la hemoglobinuria paroxística nocturna, una enfermedad que hace que los glóbulos rojos se rompan, y para el síndrome de fosfoinositida 3-quinasa delta activada, un trastorno genético que daña el sistema inmunológico. Para cánceres raros, ya hay terapias disponibles para el linfoma de células del manto, una forma agresiva de linfoma no Hodgkin, y el carcinoma nasofaríngeo, un cáncer de cabeza y cuello.
Respecto a las enfermedades pulmonares, se han aprobado nuevos medicamentos para ataques de asma y fibrosis quística. Para afecciones gastrointestinales, medicamentos para la enfermedad inflamatoria intestinal y el estreñimiento funcional pediátrico, mientras que en oncología, las aprobaciones incluyeron tratamientos para cáncer colorrectal, de próstata, de pulmón y de bajo grado (tumores menos agresivos que comienzan en el cerebro). En el área de la salud de la mujer, la FDA aprobó tratamientos para la depresión posparto, los sofocos causados por la menopausia y los anticonceptivos orales de venta sin receta.
Del mismo modo, el Centro de Evaluación e Investigación del Medicamento de la FDA identificó 20 de los 55 nuevos medicamentos (36%) como primeros en su clase (first-in-class), es decir, fármacos que tienen mecanismos de acción diferentes a los de las terapias existentes o que tratan necesidades médicas no cubiertas.
En los últimos diez años, la agencia americana ha aprobado 46 nuevos tratamientos de media cada ejercicio y estas 55 aprobaciones se han convertido en la segunda cifra más alta de la década. “Disponer de más y mejores tratamientos tiene un impacto directo en la sociedad en su conjunto, porque además de curar y controlar enfermedades, reducir los síntomas y mejorar la calidad de vida de los pacientes, potencian la eficacia y eficiencia del sistema sanitario, permiten una mayor productividad laboral y generan una importante contribución a la economía nacional”, recuerda la directora del Departamento de Acceso de Farmaindustria, Isabel Pineros.
“Pero la innovación sólo importa si llega a los pacientes, por lo que debemos impulsar que tengan un acceso más rápido, equitativo y sostenible a medicamentos innovadores y que estas innovaciones aprobadas por la FDA también lleguen a Europa para beneficio de nuestra sociedad”, valora Pineros.
En este sentido, la gran mayoría de estos nuevos medicamentos aún no han llegado a la región europea, en buena medida debido al tamaño del mercado estadounidense, a la receptividad de la innovación y a la agilidad de los procedimientos de la FDA frente a los de la Agencia Europea de Medicamentos (EMA). Es fundamental que la reforma de la legislación farmacéutica europea incluya incentivos a la innovación que mejoren el atractivo de Europa para las compañías, que la EMA sea más ágil en sus procedimientos y crear las condiciones para que las empresas decidan invertir en investigación, desarrollo y fabricación en Europa.
“Las aprobaciones de la FDA demuestran que el trabajo de nuestras compañías por seguir innovando no cesa y que se abren nuevas esperanzas de tratamiento para muchos pacientes y sus familias en numerosas áreas terapéuticas, muchas de ellas hasta ahora sin respuesta. Sin duda, son las mejores noticias para que nuestra sociedad pueda seguir avanzando”, concluye la directora del Departamento de Acceso de Farmaindustria.
 | Innovamos para las personas
| Innovamos para las personas



